26.01.2022 – Ogólna zasadowość to pomiar stężenia wszystkich substancji alkalicznych rozpuszczonych w wodzie, które mogą zarówno przyciągać, jak i uwalniać jony wodorowe. Całkowitą alkaliczność analizujemy wykorzystując miareczkowanie potencjometryczne przy użyciu półautomatycznego analizatora opracowanego i dostarczonego przez Andrew Dicksona i jego zespół z Uniwersytetu Kalifornijskiego w San Diego. Osobami odpowiedzialnymi za te analizy są dr Aleksandra Winogradow i dr Magdalena Diak.
 |
12.01.2022 – Analizy stężeń biogenów wykonywane są z użyciem automatycznego analizatora SEAL AA 500. Urządzenie to wykorzystuje podstawowe metody kolorymetryczne – pomiar intensywności barwy otrzymanych kompleksów jest następnie mierzony w spektrofotometrze. Nasz analizator posiada 5 kanałów, które umożliwiają jednoczesny pomiary PO42-, SiO2, NO2-, NO3-, NH4+. Analiza ilościowa opiera się o zastosowanie krzywej kalibracyjnej. Osobą odpowiedzialną za te analizy jest dr Marta Borecka.
 |
15.12.2021 – Analizy DOC wykonywane są w analizatorze TOC-L (Shimadzu). W celu usunięcia węgla nieorganicznego przefiltrowaną i zakwaszoną próbkę wody przed pomiarem przepłukuje się powietrzem syntetycznym. Stosowana metoda oparta jest na utlenianiu w wysokiej temperaturze (680°C) z katalizatorem Pt. Nieusuwalne organiczne związki węgla są spalane i przekształcane w CO2, który jest wykrywany przez niedyspersyjny czujnik podczerwieni (NDIR). Osobą odpowiedzialną za te analizy jest dr Aleksandra Winogradow.
 |
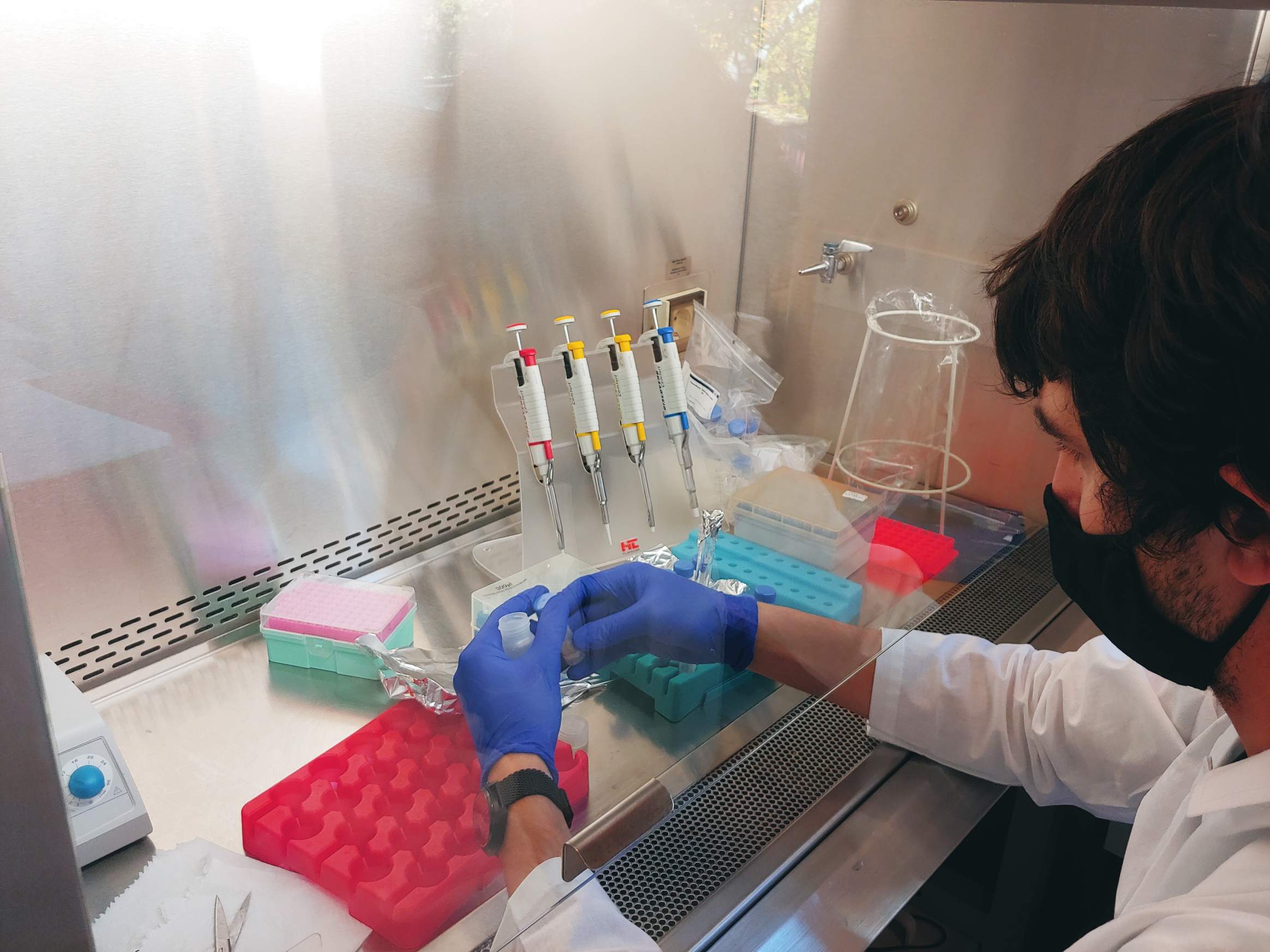
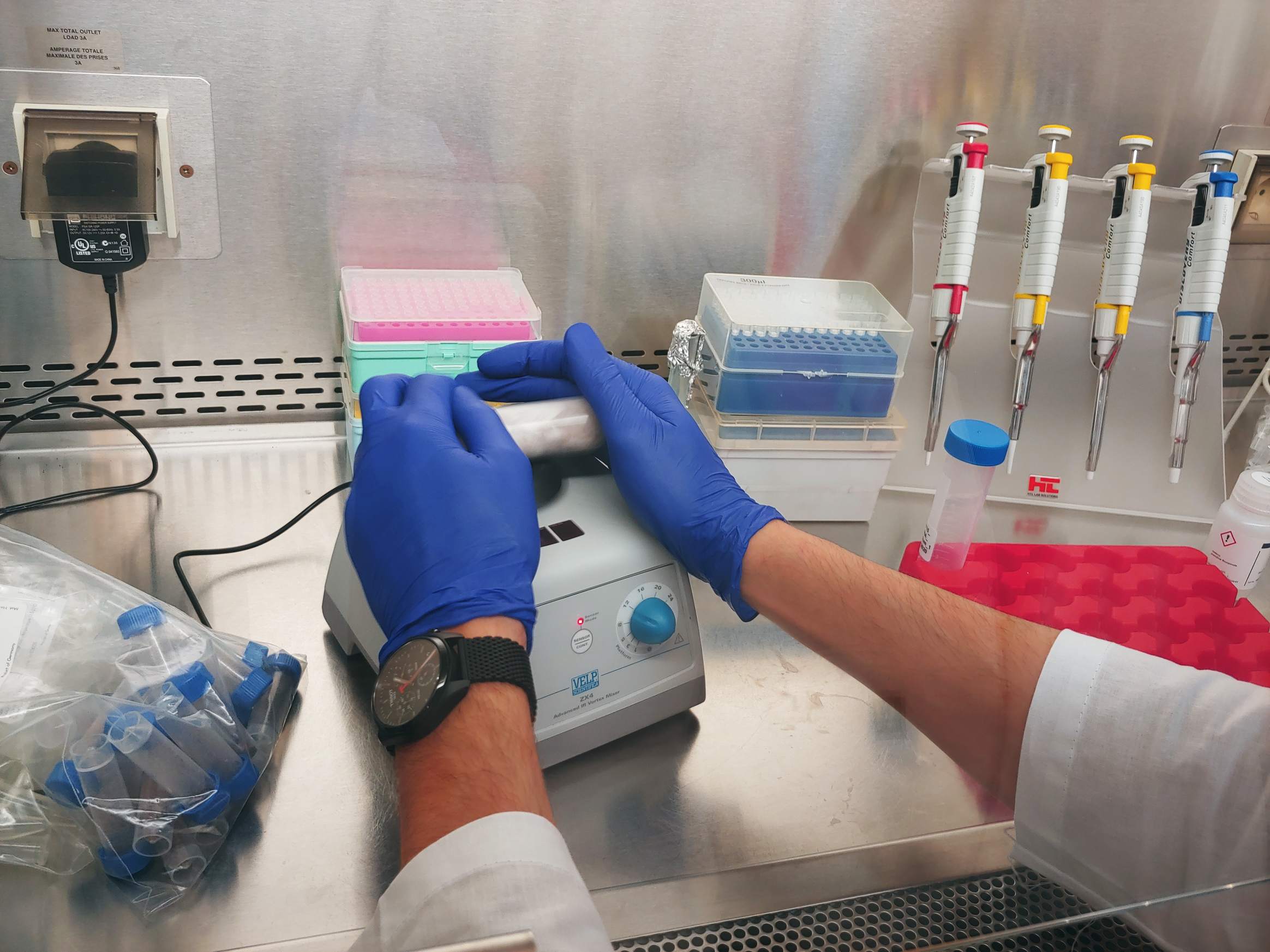
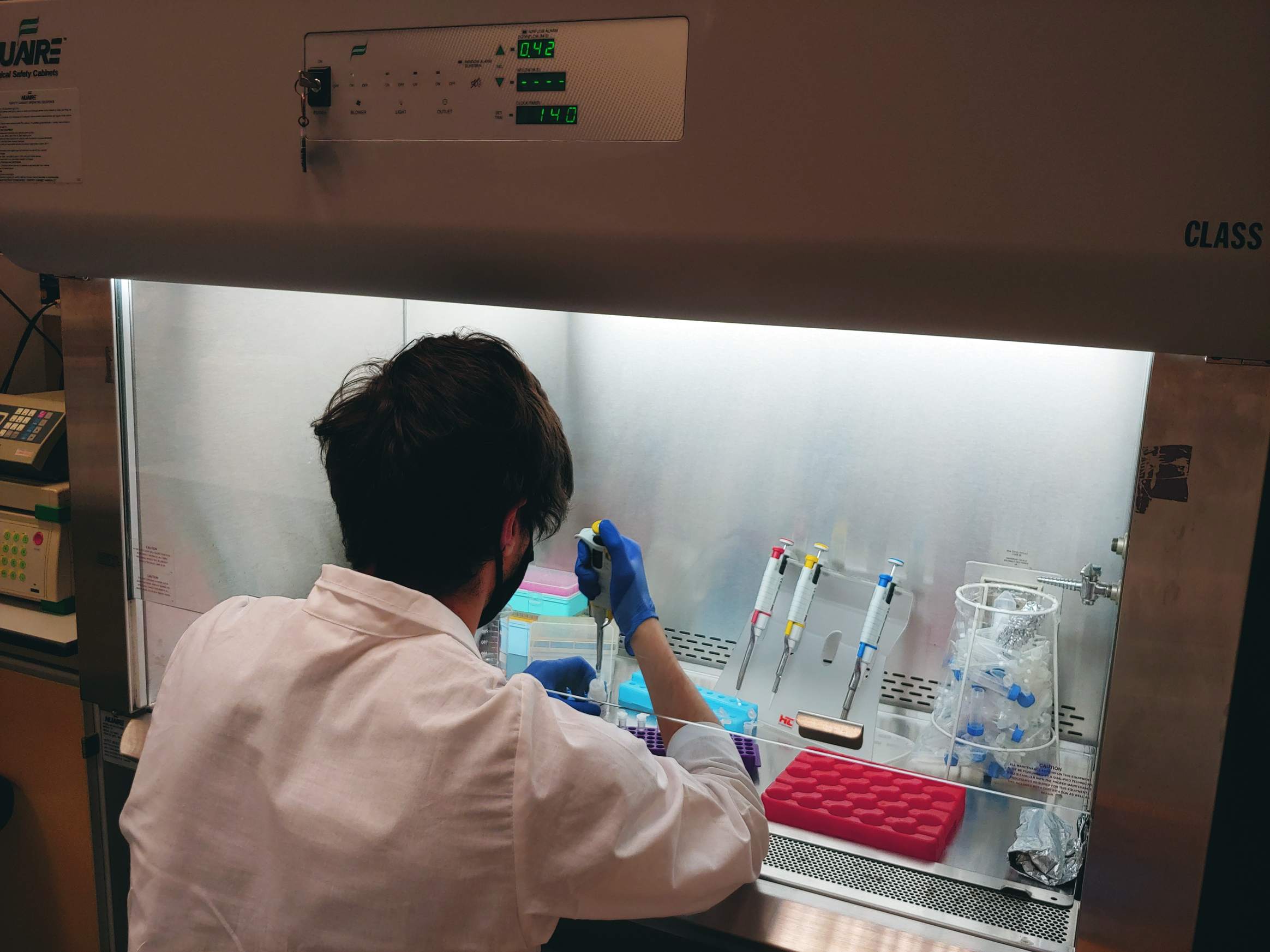
01.12.2021 – Gas Bench II to połączenie interfejsu GasBench i spektrometru IRMS. O ile za pomocą MIMS możemy mierzyć głównie 14N, o tyle z wykorzystaniem Gas Bench możemy zmierzyć wszystkie izotopy azotu. Stąd w prowadzonych przez nas eksperymentach inkubacyjnych możemy dodawać różne wzorce 15N i wykorzystywać je jako znaczniki. Co może nam dać? Możemy rozróżnić, jaki proces obserwujemy w naszych próbkach – czy jest to denitryfikacja czy anammox, czy inne reakcje jak nitryfikacja i DNRA. Jak widać próbki przygotowywane są w komorze rękawicowej wypełnionym helem, co chroni je przed zanieczyszczeniem azotem z atmosfery. Osobą odpowiedzialną za te analizy jest dr Magda Diak.
 |
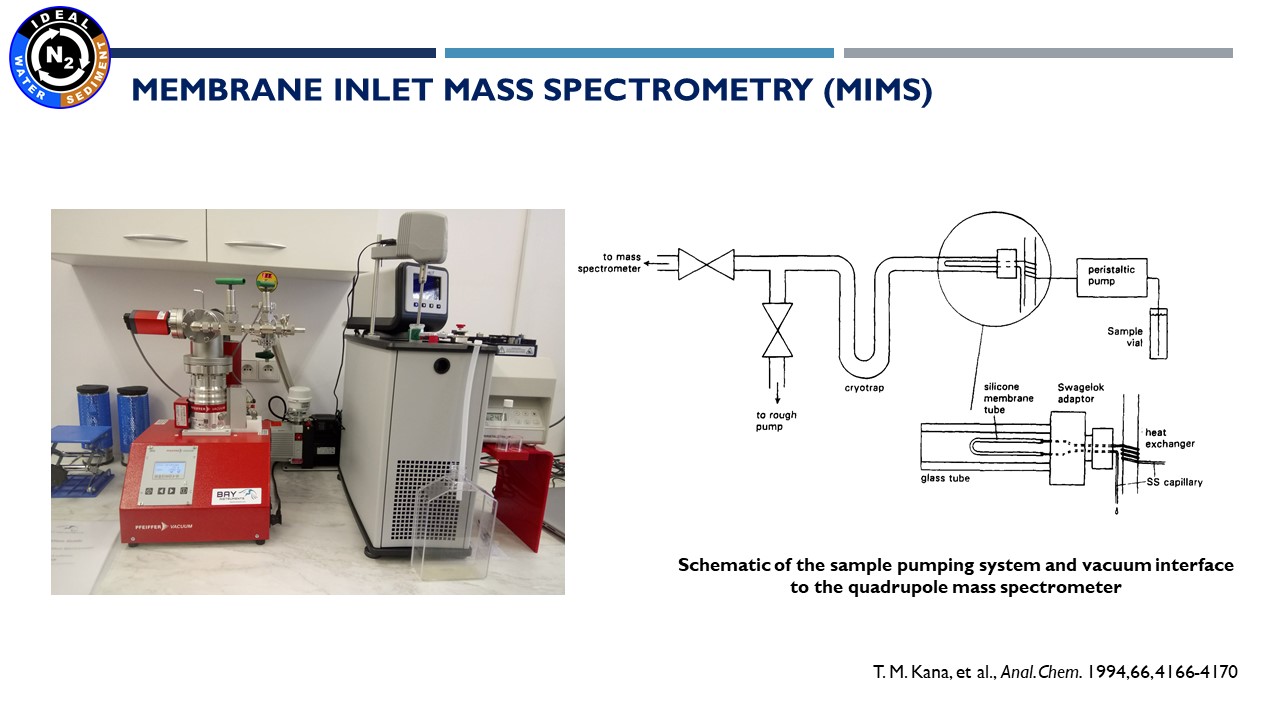
18.11.2021 – wynikiem reakcji denitryfikacji i anammox (głównych procesów, na których koncentrujemy się w naszym projekcie) jest produkcja azotu w postaci gazowej. Do pomiaru jego stężenia używamy techniki zwanej – MIMS, czyli Membrane Inlet Mass Spectrometry. Technika ta pozwala na wykonywanie szybkich i bardzo precyzyjnych pomiarów rozpuszczonego w wodzie azotu, tlenu i argonu. Osobą odpowiedzialną za te analizy jest dr Marta Borecka.
 |
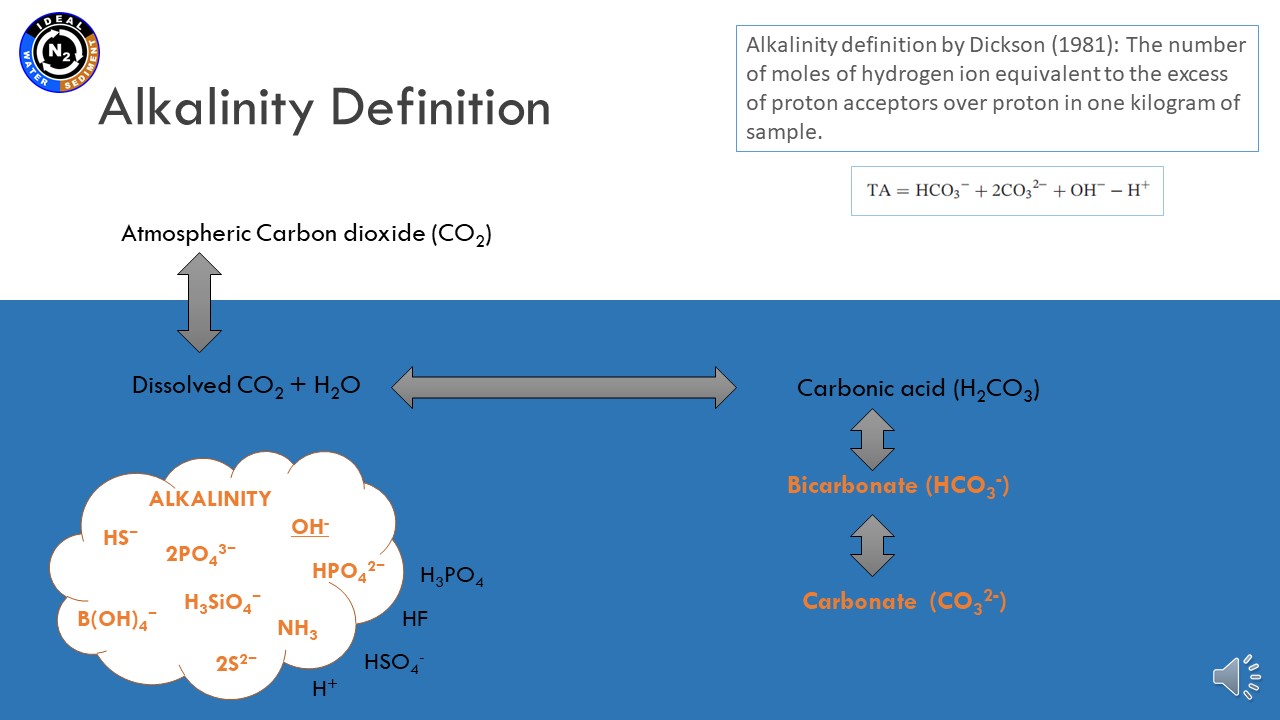
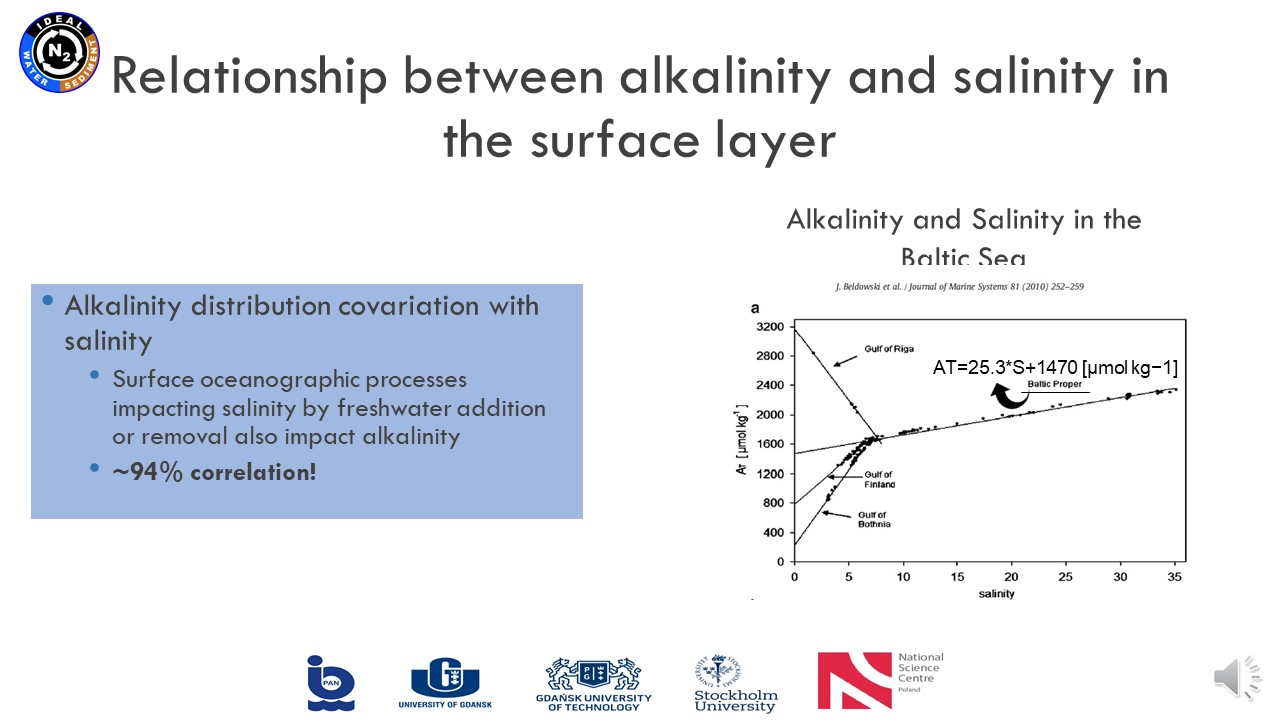
17 czerwca 2021, mgr Karina Vieira Konoplianyk - prezentacja: "Alkalinity Distribution in the Baltic Sea"
 |
 |
 |
 |
 |
 |
 |
 |
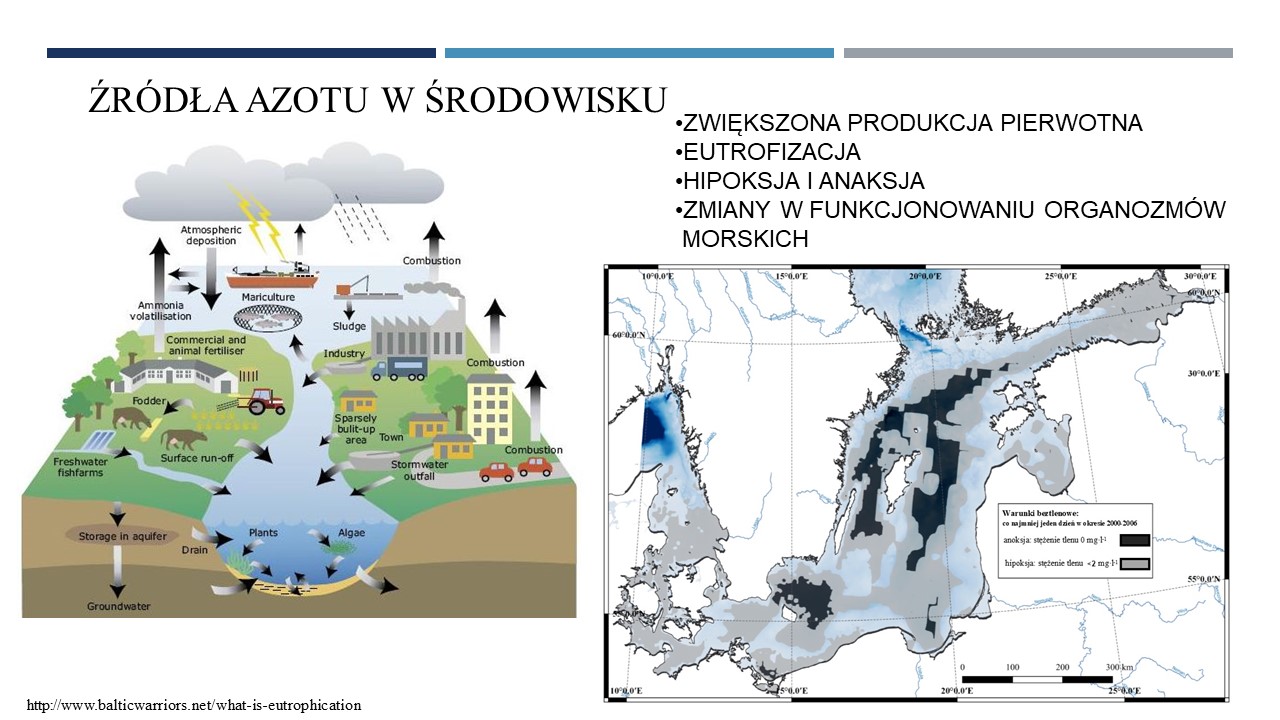
11.06.2021 - mgr Michał Grabski: "Genomiczna analiza mikrobiologicznych procesów obiegu azotu w trzech głębiach Morza Bałtyckiego"
 |
 |
 |
Kolejny rejs w projekcie IDEAL – 10-25.04.2021. Prezentujemy nasz nowy system do przygotowywania próbek do inkubacji - GloveBox.
 |
 |
 |
 |
 |
 |
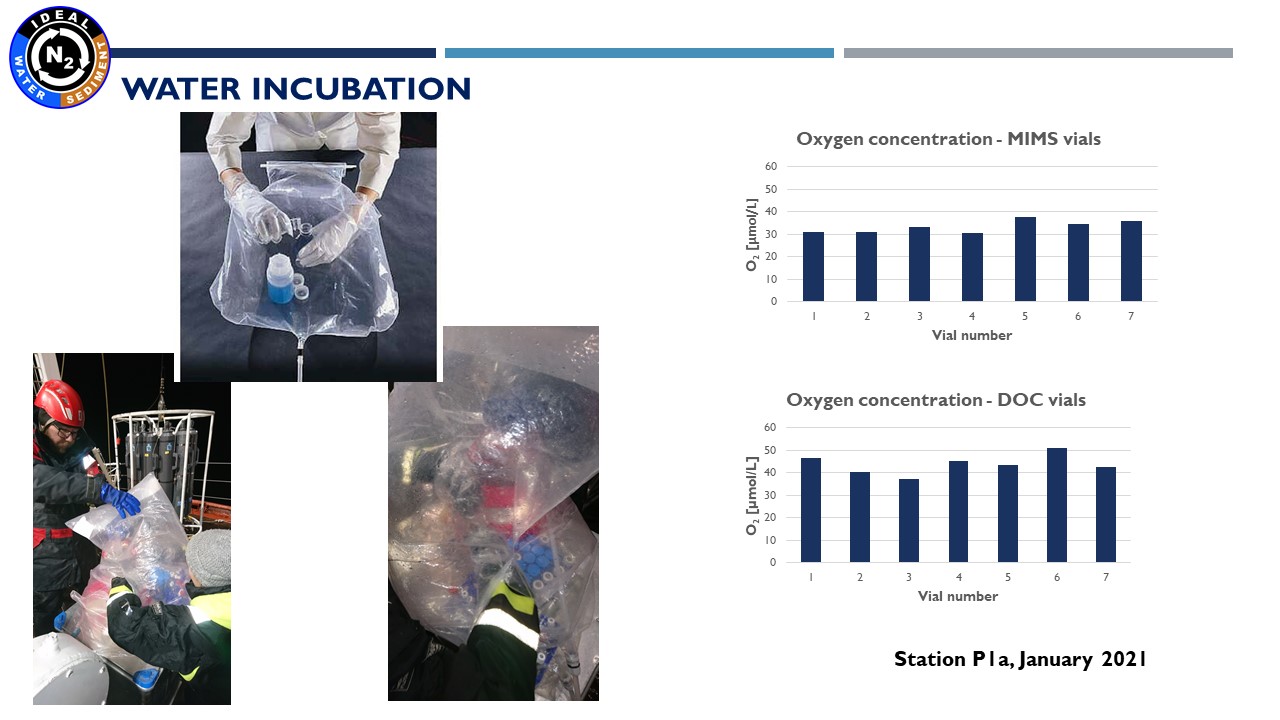
Prezentacja: "Methodology of water and sediment incubation for the estimation of denitrification. Preliminary results in IDEAL project"
(24.03.2021, dr Marta Borecka)
 |
 |
 |
 |
 |
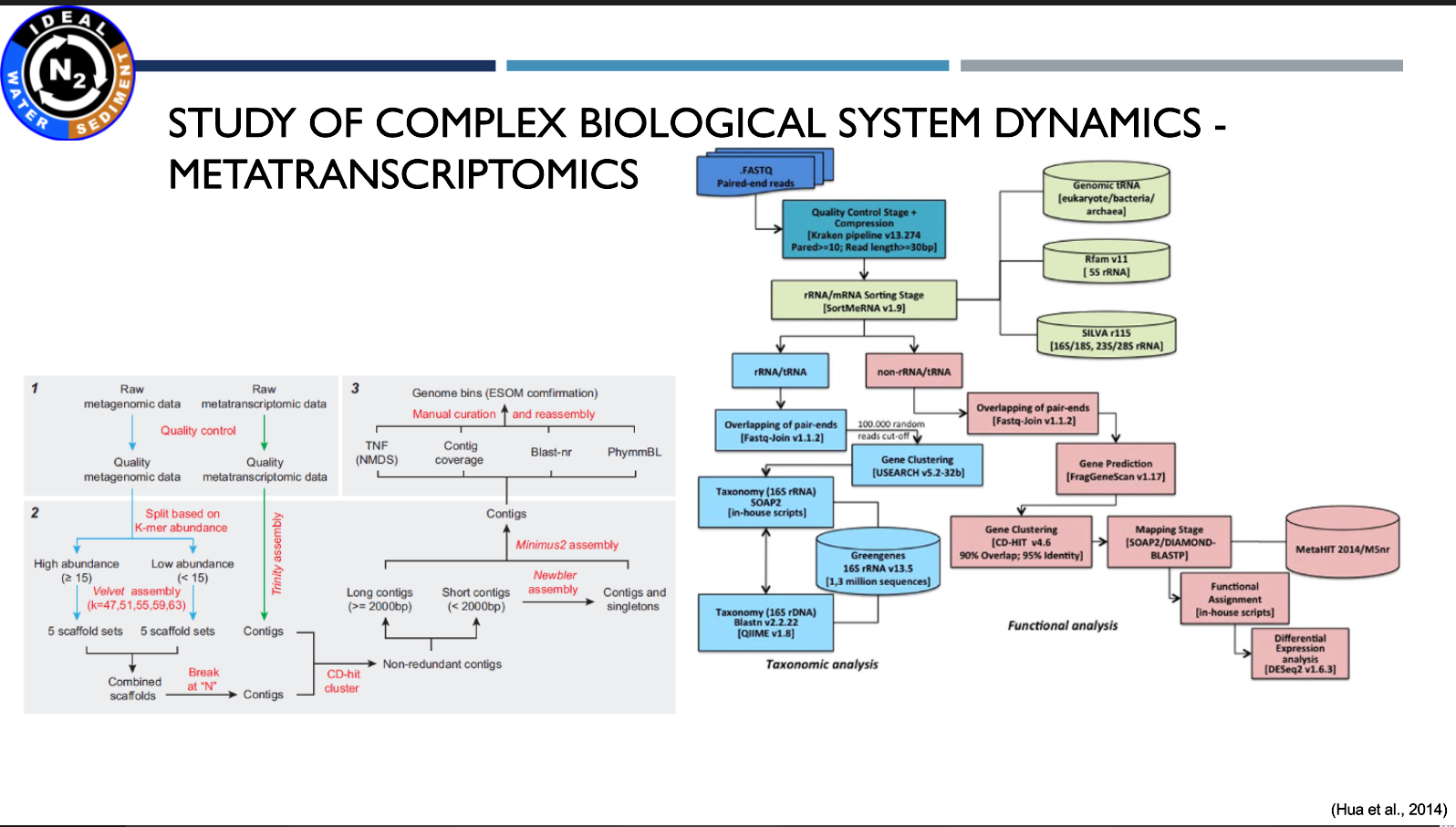
Prezentacja: "The utilisation of metagenomic and metatranscriptomic tools to solve environmental relations"
(17.03.2021, mgr Michał Grabski)
 |
 |
Prezentacja: "IDEAL project - characterization and preliminary results" (10.03.2021, dr Beata Szymczycha)
 |
 |
 |
 |
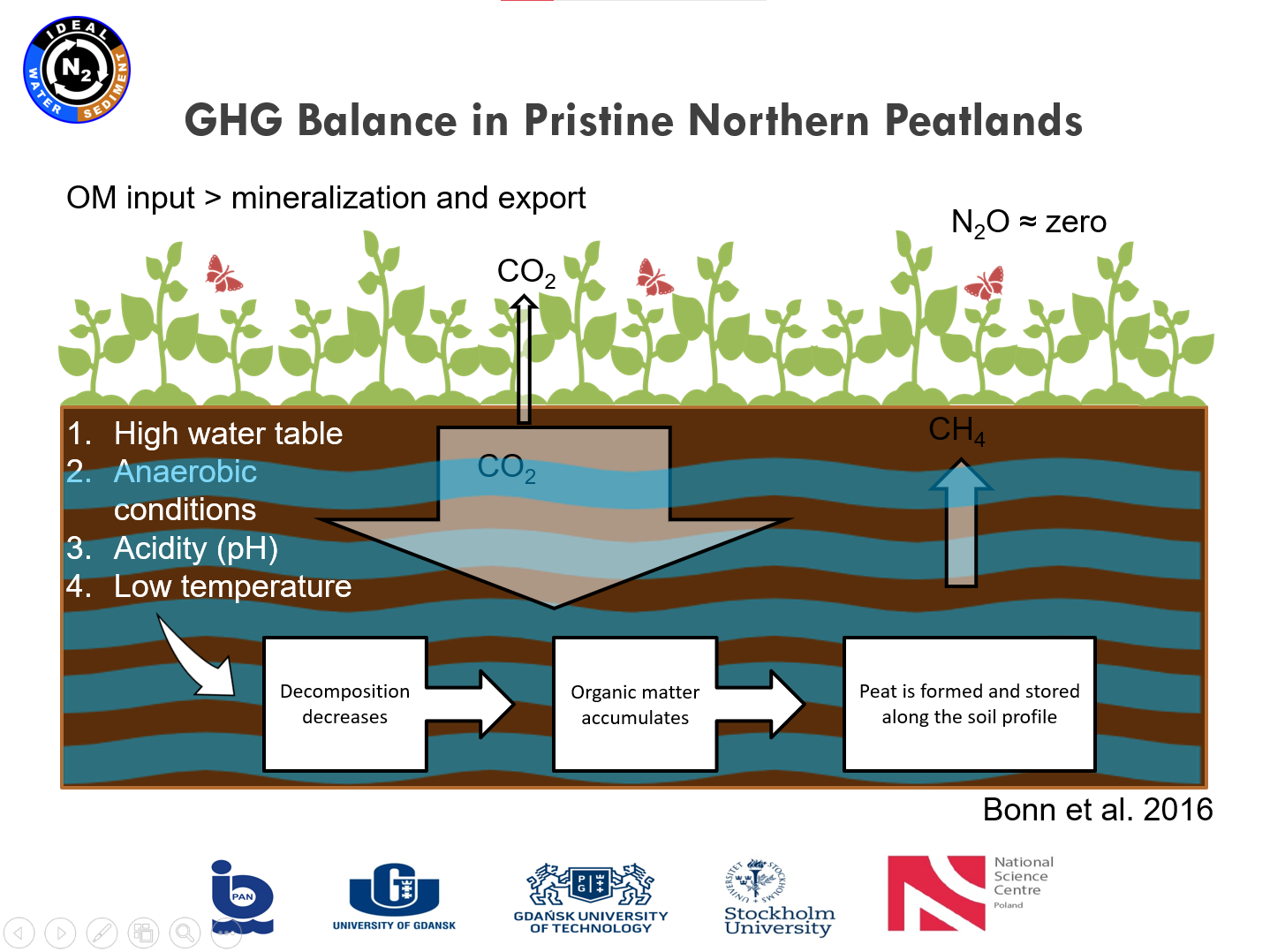
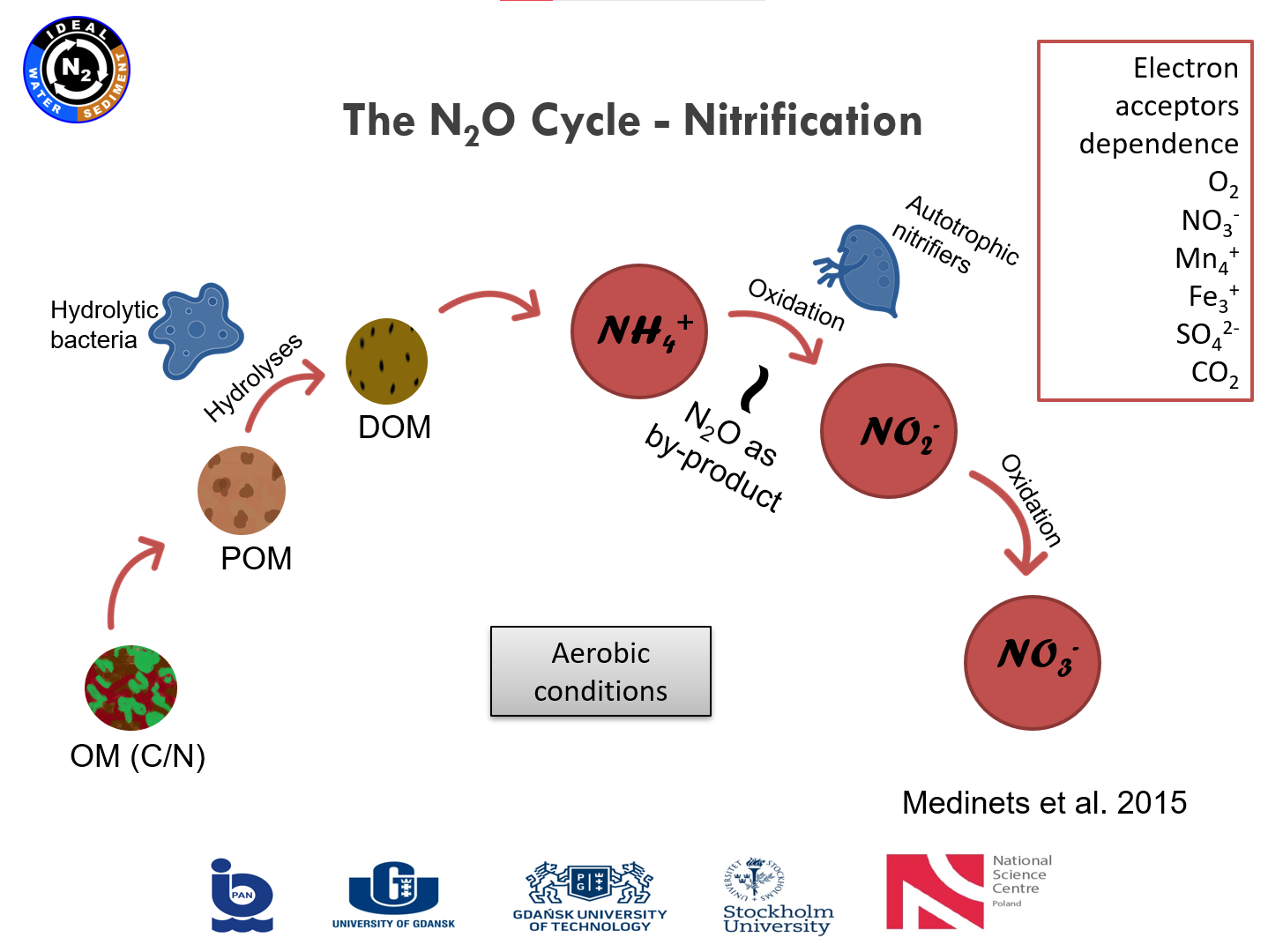
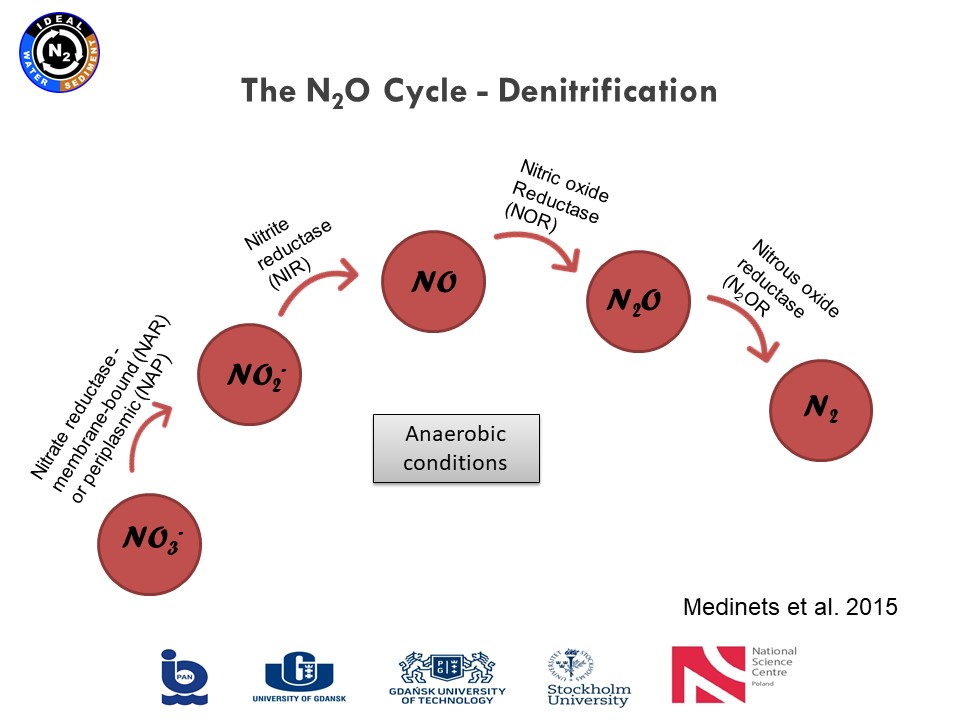
Prezentacja: "From polish mires to the Baltic Sea – a nitrogen story" (03.03.2021, mgr Karina Vieira Konoplianyk)
 |
 |
 |
 |
 |
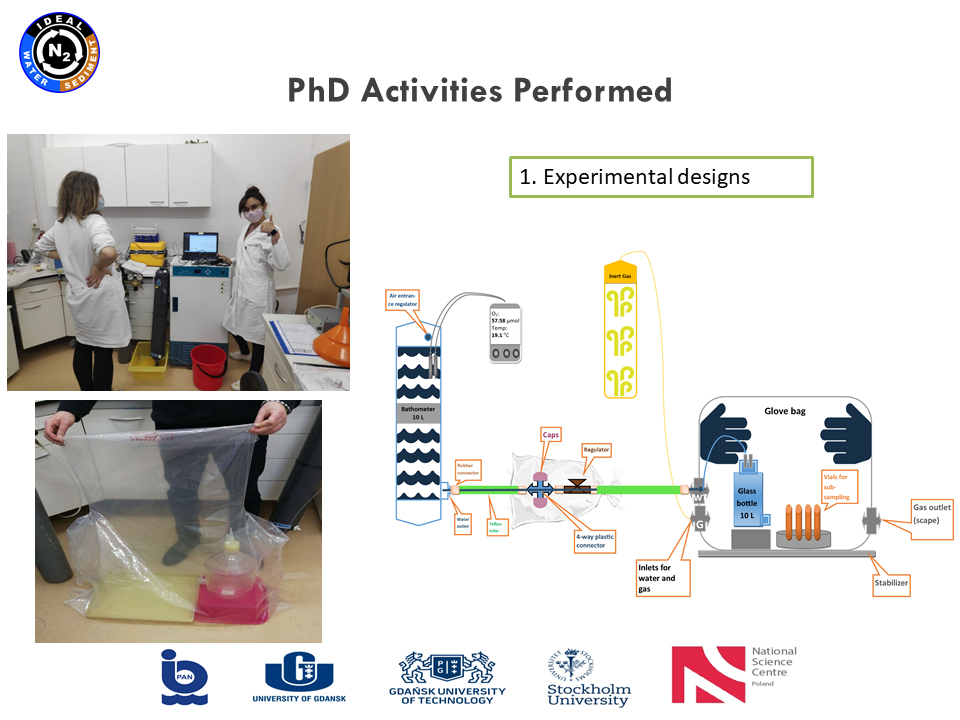 |
Drugi rejs w projekcie IDEAL - 08-21.01.2021. Nasz układ do pracy w warunkach beztlenowych się sprawdził. Glove Bag wypełniony helem pomógł nam w osiągnięciu założonego celu. Niestety jak widać na załączonych zdjęciach praca w nim nie jest łatwa.
 |
 |
 |
 |
 |
 |
 |
 |
Grudzień 2020. Podczas pierwszego rejsu badawczego napotkaliśmy problem związany z kontaminacją pobieranych próbek tlenem. Eksperymenty inkubacyjne przeprowadzane podczas rejsu powinny odzwierciedlać warunki środowiskowe. Pobieramy wody anoksyczne, ponieważ organizmy denitryfikujące wymagają bardzo niskiego stężenia tlenu. W związku z tym powinniśmy zachować szczególną ostrożność podczas pobierania próbek, aby nie wprowadzić do nich tlenu. W tym celu musieliśmy stworzyć system wypełniony gazem obojętnym. System sprawdził się w laboratorium, więc mamy nadzieję, że sprawdzi się również w terenie
 |
 |
 |
 |
Listopad 2020. Przygotowania do naszego kolejnego rejsu trwają. Testujemy układ do filtracji próbek na analizy metagenomiczne i metatranskryptomiczne. Czyli dla mniej wtajemniczonych - będziemy badać jakie bakterie żyją w pobieranych przez nas próbkach i jakie są ich zadania.
Październik 2020. Nasz doktorant Michał rozpoczął właśnie testy izolacji DNA z pobranego podczas wrześniowego rejsu materiału. To kolejny etap analiz metagenomicznych, które pozwolą nam na identyfikację oraz dokonanie charakterystyki mikroorganizmów obecnych w pobranych przez nas próbkach. Dzięki temu będziemy mogli ocenić wpływ aktywności bakterii na procesy usuwania azotu w osadzie dennym i kolumnie wody morskiej.
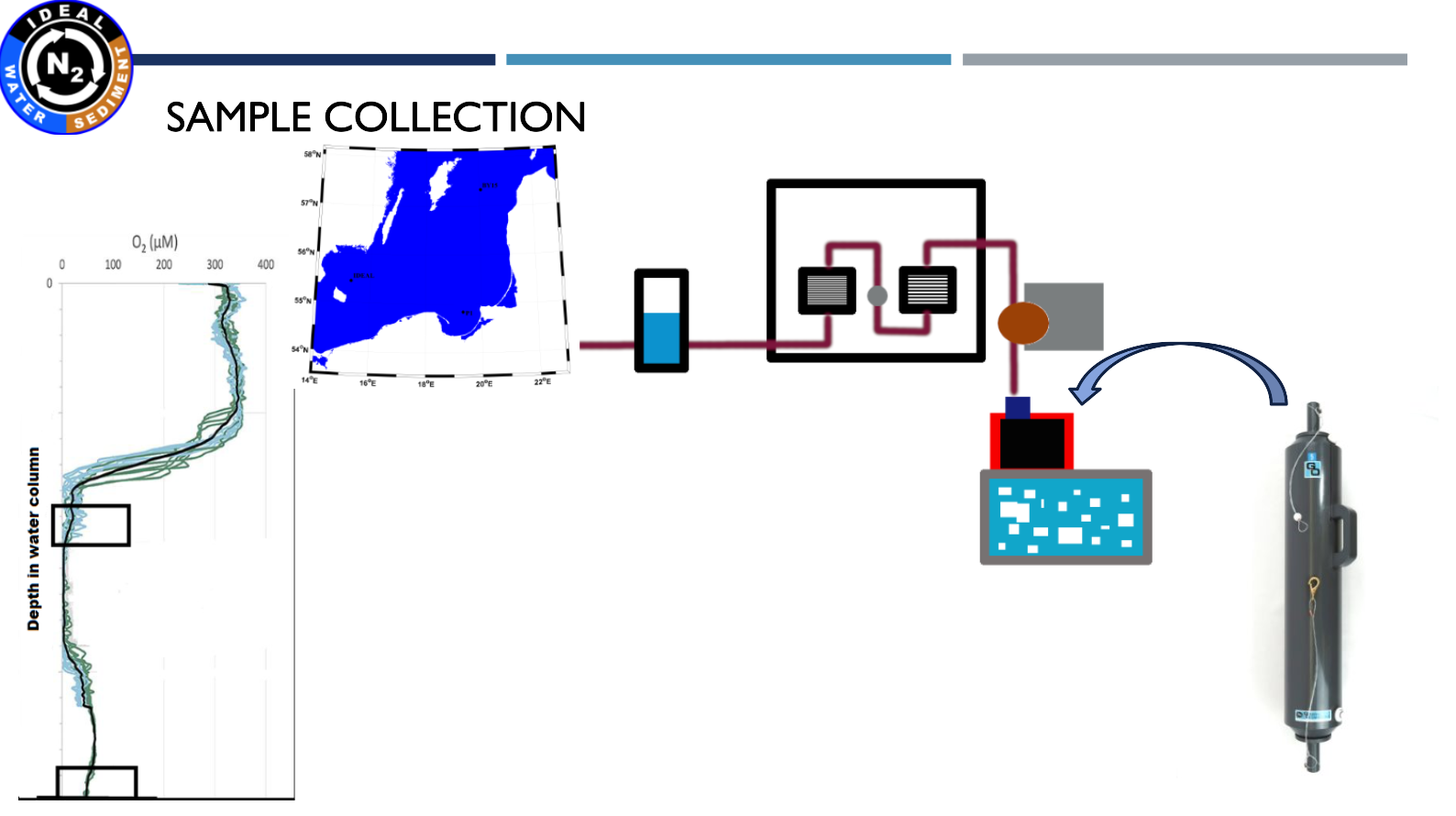
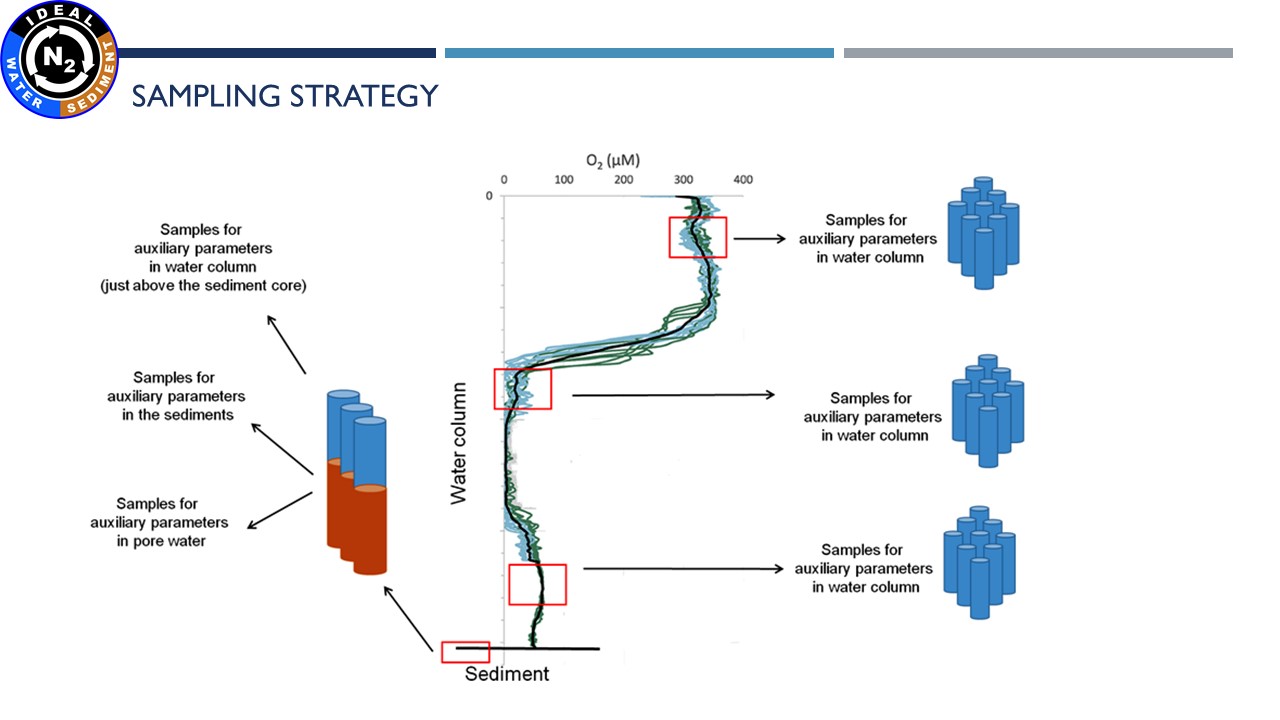
| Pobraliśmy próbki z Głębi Bornholmskiej, Głębi Gotlandzkiej i Głębi Gdańskiej. |







|
| Przygotowanie rdzeni oraz ich inkubacja |



|
| Pobranie oraz filtracja próbek wody na analizy metagenomiczne i metatranskryptomiczne |
  |
  |
 |
 |
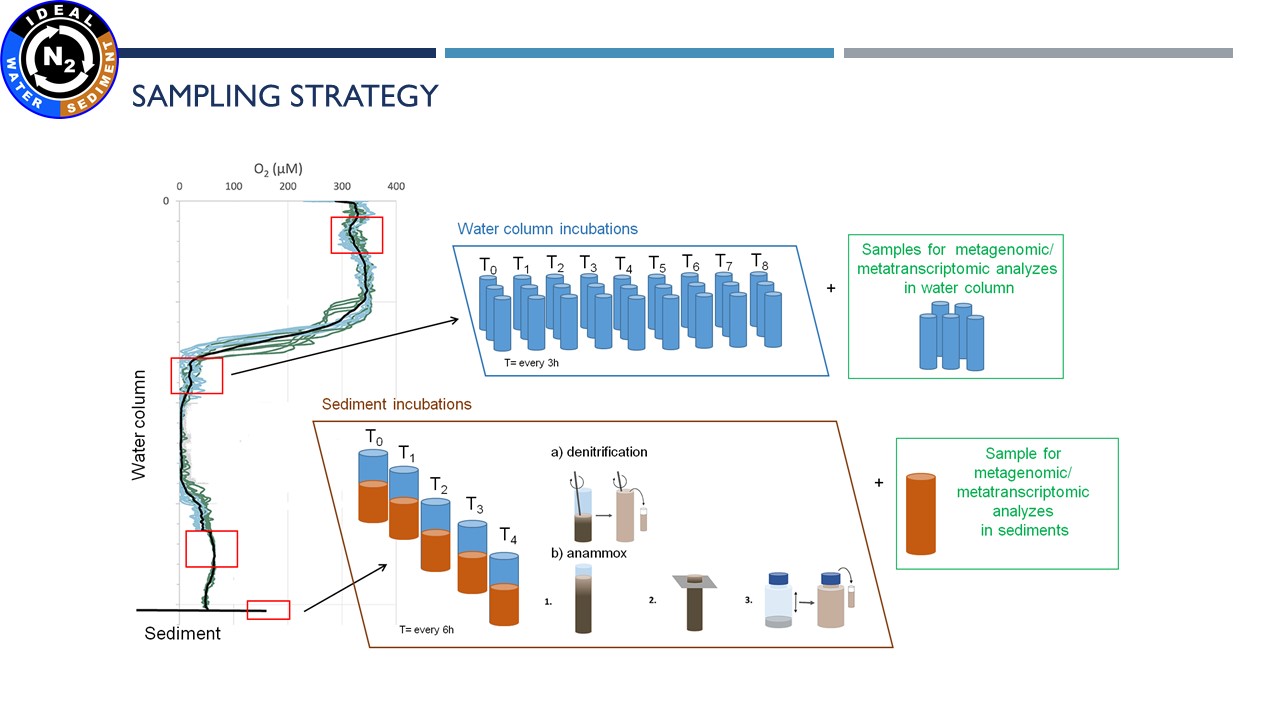
| Przygotowanie próbek osadów do inkubacji | Pobranie wód porowych | Cięcie rdzenia | Inkubacja próbek wodnych |
 Spektrometr masowy z wlotem membranowym (MIMS) |
 Analizator Węgla Organicznego TOC-L (Shimadzu) |
 Spektrometr mas ze wzbudzeniem w plazmie indukcyjnie sprzężonej z podajnikiem próbek (Perkin Elmer) |


Analizator elementarny CHN sprzężony ze spektrometrem mas Delta V Advantage (Thermo Scientific) |