Projekt nr 2 – Charakterystyka fizyko-chemiczna wód,
|

|
(do pobrania)
 formularz zbioru danych
formularz zbioru danych
Podstawowe zasady poboru próbek wody na analizy fizyko-chemiczne
Przy pobieraniu próbek wody z akwenów stojących (jeziora, stawy) należy unikać miejsc mocno zarośniętych roślinami wodnymi. W wodach płynących (rzeki, potoki, strumyki) wodę należy pobierać w miejscu gdzie nurt jest najsilniejszy. Należy pamiętać, aby nie pobierać wody w spokojnych miejscach potoku czy strumienia (zatoczki, odnogi). Podczas zbioru prób na analizy składu chemicznego należy zwrócić uwagę, aby dodatkowo nie zanieczyścić analizowanej próbki.
Temperatura wody
Temperatura wody zależy przede wszystkim od ilości energii słonecznej przez nią zaabsorbowanej. Oczywistym jest, iż temperatura wody reguluje tempo przebiegu wszystkich reakcji chemicznych, jak również na aktywność życiową organizmów (tempo odżywiania, metabolizm, wzrost). Temperatura bezsprzecznie wywiera ona silny wpływ na liczebność i różnorodność życia w rezerwuarach wodnych. Mówi się, iż wyższa temperatura to większa rozmaitość form życia, wynikająca z uwarstwienia termicznego w zbiornikach morskich i jeziorach: Przy powierzchni woda jest ciepła, głębiej umiarkowana, a przy dnie chłodna. Pomiar temperatury wody pomogą zrozumieć prawidłowości zmian dokonujących się w ciągu roku w zbiorowiskach organizmów mieszkających w wodzie. Należy jednak pamiętać, że ciepła woda może być zgubna dla niektórych bardzo wrażliwych organizmów, wymagających wody zimnej i bogatej w tlen.
Jak mierzyć temperaturę wody?
Bezpośrednio po pobraniu próbek wody, uczniowie dokonują pomiaru jej temperatury [w próbce, zlewce lub in situ (zanurzając przyrząd bezpośrednio w cieku wodnym). Ważne jest odczekanie do momentu, gdy wskazania temperatury mierzone termometrem będą stałe. Należy również zwrócić uwagę, aby termometr nie był wystawiony na bezpośrednie działanie promieniowani słonecznych.
Odczyn (pH)
Miarą zawartości kwasów w wodzie jest pH. Odczyn wody wywiera wpływ na wiele zachodzących w niej procesów chemicznych, jednakże trudno jest rozróżnić bezpośrednie i pośrednie działanie pH na organizmy, które w stosunku do pH mają określony zakres tolerancji i zakres optimum. Czysta woda, bez zanieczyszczeń (i bez kontaktu z powietrzem) ma pH równe 7.0. Skala pH jest odmienną do skal określających inne parametry fizyko-chemiczne. Jest to skala logarytmiczna, co oznacza, że zmiana pH o jedną jednostkę oznacza dziesięciokrotny przyrost lub spadek zawartości kwasu w wodzie. Naturalny, nie zanieczyszczony deszcz ma pH w przedziale między 5 a 6, gdyż woda deszczowa, nawet pochodząca z najmniej zanieczyszczonych miejsc na Ziemi, ma pewną naturalną kwasowość. Wiąże się ona z obecnością w atmosferze dwutlenku węgla, rozpuszczanego w kropli deszczu. Okazuje się jednak, że opady atmosferyczne są groźne dla małych zbiorników wodnych, które są słabo buforowane i mogą ulec zakwaszeniu. Właśnie takie rezerwuary wodne stanowią przedmiot zainteresowania młodych badaczy, który zdecydowali podjąć realizacji projektu 2.
Organizmy wodne mają w stosunku do pH określony zakres tolerancji a tym samym zakres optimum. Tak, więc bezsprzecznie, odczyn wody wywiera wpływ na życie w zbiorniku. Salamandry, żaby i inne organizmy ziemno-wodne są bardzo wrażliwe na niskie pH. Większość gatunków owadów, ryb i płazów nie znajdziemy w wodach o pH mniejszym od 4. Najgroźniejsze działania uboczne oddziaływujące na zwierzęta są związane ze zmianami pH wody. Wiążą się one z przesunięciem równowagi w układzie jony amonowe - niezdysocjowany amoniak. Jony amonowe nie są szkodliwe, natomiast amoniak jest trujący. Gdy wysokie stężenie amoniaku towarzyszy wzrostowi pH (tak jak dzieje się to w słabo buforowanych, obciążonych ściekami zbiornikach) może dojść do nagłego wymierania ryb, ponieważ krytyczna wartość pH zostaje przekroczona i stężenie amoniaku wzrasta w stopniu zagrażającym niektórym organizmom.
Zmiany pH wpływają na poziom regulacji jonowej, który wymaga od zwierząt dużych, nakładów energii, co ma znaczący wpływ na obniżenie tempa reprodukcji oraz podwyższonej śmiertelności gatunków wrażliwych na zmiany pH.

Pomiary wykonywane za pomocą papierka lakmusowego
(Marcin Gwiazda)

Pomiary wykonywane miernikiem elektronicznym
(Marcin Gwiazda) Jak mierzyć pH
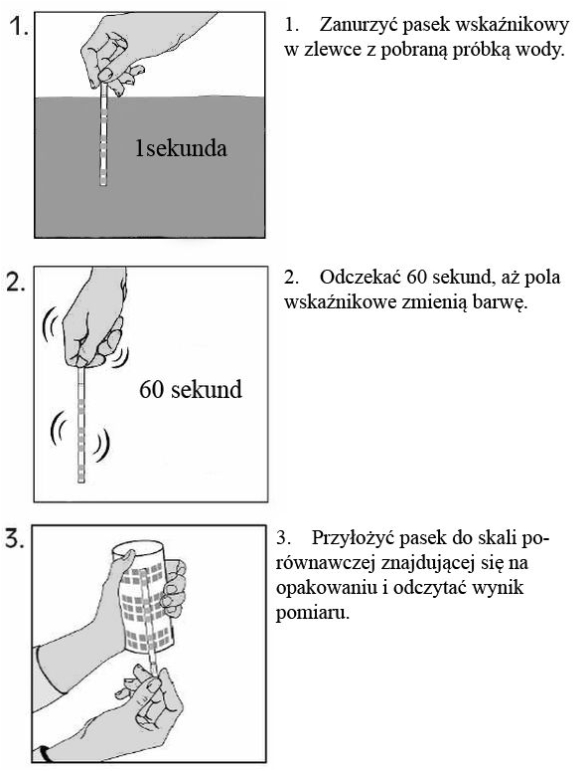
Metoda: papier lakmusowy
1. Zlewkę o pojemności 50 ml lub 100 ml, co najmniej dwukrotnie płuczemy wodą z badanego zbiornika.
2. Zlewkę napełniamy wodą przeznaczoną do badania mniej więcej do połowy jej wysokości.
3. Zanurzamy w wodzie pasek papieru lakmusowego i trzymamy go tam około 1 minuty. Upewniamy się, czy wszystkie cztery sektory paska są zanurzone.
4. Wyjmujemy pasek z wody i porównujemy go ze skalą pH umieszczoną na opakowaniu. Staramy się odnaleźć taką sekwencję, w której wszystkie cztery kolory sektorów są identyczne z kolorami na skali.
5. Jeżeli kolory nie są wyraźne, może to świadczyć o zbyt krótkim trzymaniu paska w wodzie. Jeżeli to jest przyczyną słabej reakcji papieru, należy go ponownie umieścić w wodzie na czas 1 minuty. Czynność tą należy powtarzać aż do chwili osiągnięcia zadowalających rezultatów. Jeżeli jednak nawet po dziesięciu minutach odczyt jest niemożliwy, zaczynamy pomiar z wykorzystaniem nowego paska papieru. W przypadku powtórnego niepowodzenia, fakt ten zapisujemy.
Metoda alternatywna: Na rynku dostępne są równie wodoszczelne mierniki do wszystkich ważnych parametrów dotyczących cieczy, wykorzystywane najczęściej przez akwarystów. Takie elektroniczne urządzenie pozwala wykonać pomiar kilku parametrów w naszym przypadku pH, przewodności, całkowita zawartość stałych związków rozpuszczonych, zawartość soli oraz temperatury. Aby zmierzyć pH należy wstawić końcówkę elektrody do wody lub umożliwić kontakt z wilgotną powierzchnią.
Azotany
W wodach naturalnych mogą być obecne teoretycznie wszystkie pierwiastki i związki chemiczne notowane w skorupie ziemskiej. Woda morska rzeczywiście zawiera bogaty skład pierwiastków i związków chemicznych. Wody śródlądowe zawierają znacznie mniejsze stężenia wymienionych składników, aczkolwiek zawsze istnieją wyjątki od tej reguły. Wpływ na różnorodność składu chemicznego wód ma wiele czynników. Substancje chemiczne do zbiorników wodnych dostarczane są wraz z opadami jak i zrzutami wód zanieczyszczonych w wyniku działalności człowieka. Ponadto wpływ na skład wody mają również procesy biologiczne, chemiczne i fizyczne np. parowanie. Jednak najważniejszym źródłem związków chemicznych jest rozpuszczanie skał podłoża. Rośliny zarówno w wodach słodkich jak i zasolonych potrzebują trzech głównych składników niezbędnych dla ich wzrostu – węgla, azotu i fosforu. Większość roślin pobiera te trzy składniki pokarmowe w stałych proporcjach, ich wzrost jest zagrożony, gdy pojawi się niedostatek jednego z nich. Węgiel jest pierwiastkiem powszechnie dostępnym, gdyż występuje w atmosferze jako dwutlenek węgla, rozpuszczalny w wodzie. Tak, więc jedynie dostępność dwóch pozostałych składników, azotu i fosforu, może ograniczać wegetację roślin wodnych. Rośliny zużywają w dużej ilości sole kwasu azotowego i sole amonowe. Bardzo rzadko korzystają z wolnego azotu rozpuszczonego w wodzie. Zwiększenie zawartości substancji pokarmowych w wodach powierzchniowych, w tym azotanów(tzw. eutrofizacja), prowadzi do przyspieszenia rozwoju populacji fotosyntetyzujących glonów. Jest to zjawisko tzw. zakwitania glonów. Koncentrację azotanów wykazujemy zawsze posługując się zawartością azotu. Zawartość azotanów opisujemy jako ilość azotu w azotanach w miligramach na litr (np. 14 gramów azotu na cząsteczkę NO3), nigdy zaś jako NO3 (tzn. 62 gramy na cząsteczkę NO3). W większości zbiorników wód naturalnych stężenie azotanów wynosi poniżej 1 mg/l azotu, lecz zdarza się, że przekracza w pewnych rejonach nawet 10 mg/l.
Schemat oznaczenia zawartości azotanów w próbce „ukrytej wody”. Źródło: http://www.acuariosdepared.com/SERA-Quick-Test-1
Jak mierzyć Azotany
W laboratoriach naukowych azotany oznacza się metodą spektrofotometryczną z salicylanem sodu przy długości fali 410 nm. Natomiast, w badaniach terenowych wykonywanych na potrzebę projektu nr 2 postępujemy analogicznie do pomiarów pH, tylko używamy specjalnych papierków służących do określania poziomu azotanów, stosowanych rutynowo do analizy jakości wody w akwariach.
Przewodnictwo
Woda jest dobrym izolatorem, jednak tylko woda destylowana nie przewodzi prądu. Woda w przyrodzie nie występuje nigdy jako czysty związek chemiczny. Sole nieorganiczne w wodzie składają się z dodatnio naładowanych kationów oraz ujemnie naładowanych anionów - które będą przewodzić prąd elektryczny po przyłożeniu napięcia pomiędzy dwoma elektrodami zanurzonymi w wodzie. Jakakolwiek woda występująca w zbiornikach naturalnych zawiera domieszki związków i pierwiastków chemicznych, których skład decyduje o stopniu przewodzenia prądu.
Jak mierzyć przewodnictwo wody?
W warunkach terenowych pomiar przewodnictwa wykonywany jest prostym miernikiem, wykorzystywanym rutynowo przez akwarystów. Aby zmierzyć przewodność należy ustawić próbkę w pojemniku do próbkowania tak, aby elektroda była przykryta płynem do wysokości minimum 250 mm. Należy pamiętać, aby przed pomiarem usunąć pęcherzyki powietrza, w tym celu należy zamieszać roztwór.

